我院辛涛教授团队在胶质母细胞瘤发病机制研究中取得新进展
2022-08-05 14:36科研处
可变剪接是一种进化上高度保守的细胞转录后过程,可驱动真核生物中转录组和蛋白质组的多样性。可变剪接的异常转变与癌症中诸多恶性特征密切相关,是肿瘤进展和治疗干预的重要标志物。胶质母细胞瘤(Glioblastoma,GBM)以其高度异质性和临床进展迅速而闻名,是成人中最常见同时最具侵袭性的颅内原发性恶性肿瘤。研究表明,GBM中异常剪接产物作为致癌驱动因素发挥关键作用,导致肿瘤内高度异质性以及恶性表型转变。近年来,长链非编码RNA(Long noncoding RNA,lncRNA)作为一类新兴的表观遗传调控分子,在肿瘤发生和恶性进展中发挥重要驱动作用。然而在GBM异常可变剪接调控方面,大多数lncRNA的功能和生物学意义目前仍然难以捉摸。
近日,山东第一医科大学第一附属医院(山东省千佛山医院)辛涛教授团队与山东大学基础医学院刘倩教授团队在Nature旗下期刊Cell Death Differentiation(中科院一区,IF: 12.067)发表题为“N6-Methyladenosine-modified lncRNA LINREP promotes Glioblastoma progression by recruiting the PTBP1/HuR complex”的研究论文。首次揭示了lncRNA LINREP通过调控RTN4可变剪接促进GBM进展的新机制,为GBM的诊疗提供了新的靶点。辛涛、刘倩教授为论文的共同通讯作者,山东大学硕士研究生纪小帅、博士研究生刘子豪与硕士研究生高佳佳为论文的共同第一作者。
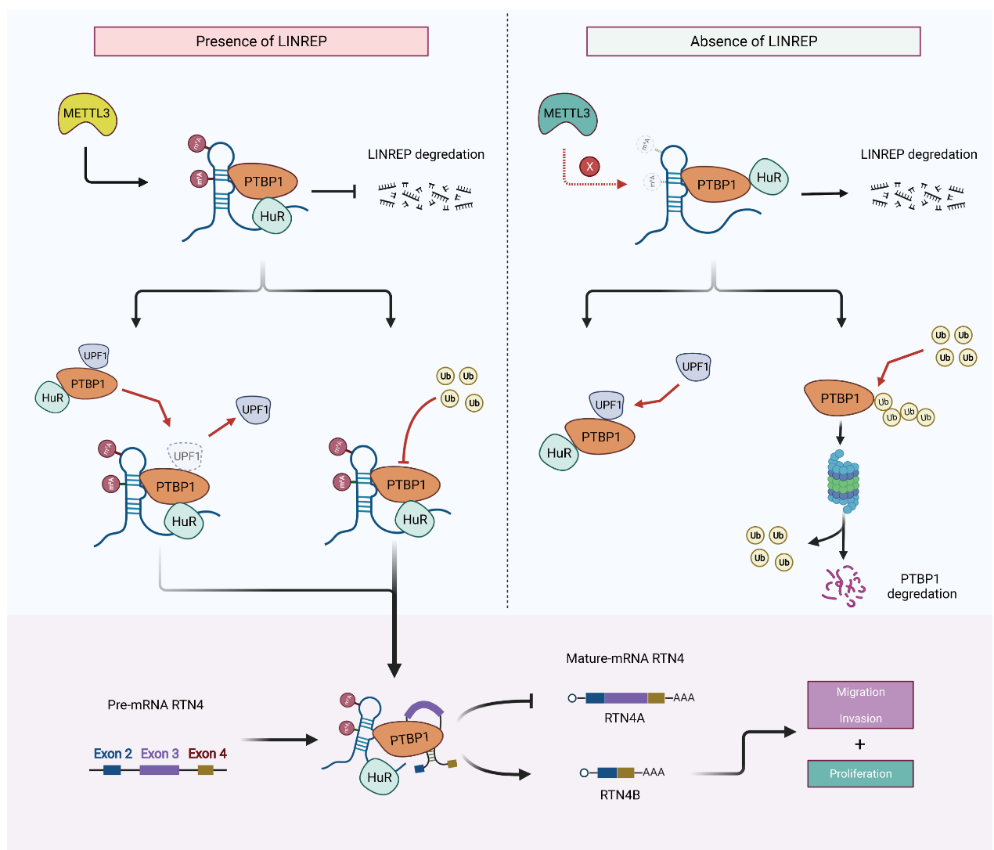
本研究揭示了新型长链非编码RNA LINREP与剪接因子PTBP1介导GBM可变剪接失调之间的功能联系。机制上,LINREP通过稳定PTBP1蛋白进而调控其下游一系列致癌基因的可变剪接事件,尤其是参与RTN4 3号外显子跳跃突变。同时,LINREP促进UPF1与PTBP1解离,从而增加PTBP1与RTN4转录本结合,进一步增强了RTN4 3号外显子的跳跃突变,最终促进GBM细胞的增殖、侵袭等恶性表型。此外,METTL3介导LINREP的m6A甲基化修饰,促进HuR结合并稳定m6A修饰的LINREP,导致LINREP表达上调。本研究对长链非编码RNA在GBM异常剪接调控中的重要功能及分子机制进行探究,为寻找GBM临床诊断和预后评估的生物标志物及药物治疗靶点提供了新的视角。
辛涛教授团队长期致力于胶质瘤基因改变与表达调控、表观遗传修饰与胶质瘤代谢免疫、肿瘤微环境重塑等方向的研究,研究成果发表在J Exp Clin Cancer Res、BMC Med等国际权威期刊上,本研究得到了国家自然科学基金及山东省自然科学基金重点项目等课题的资助。